Por Richard Lamar, Doctor
Director de Investigación Húmica
Bio Huma Netics, Inc.

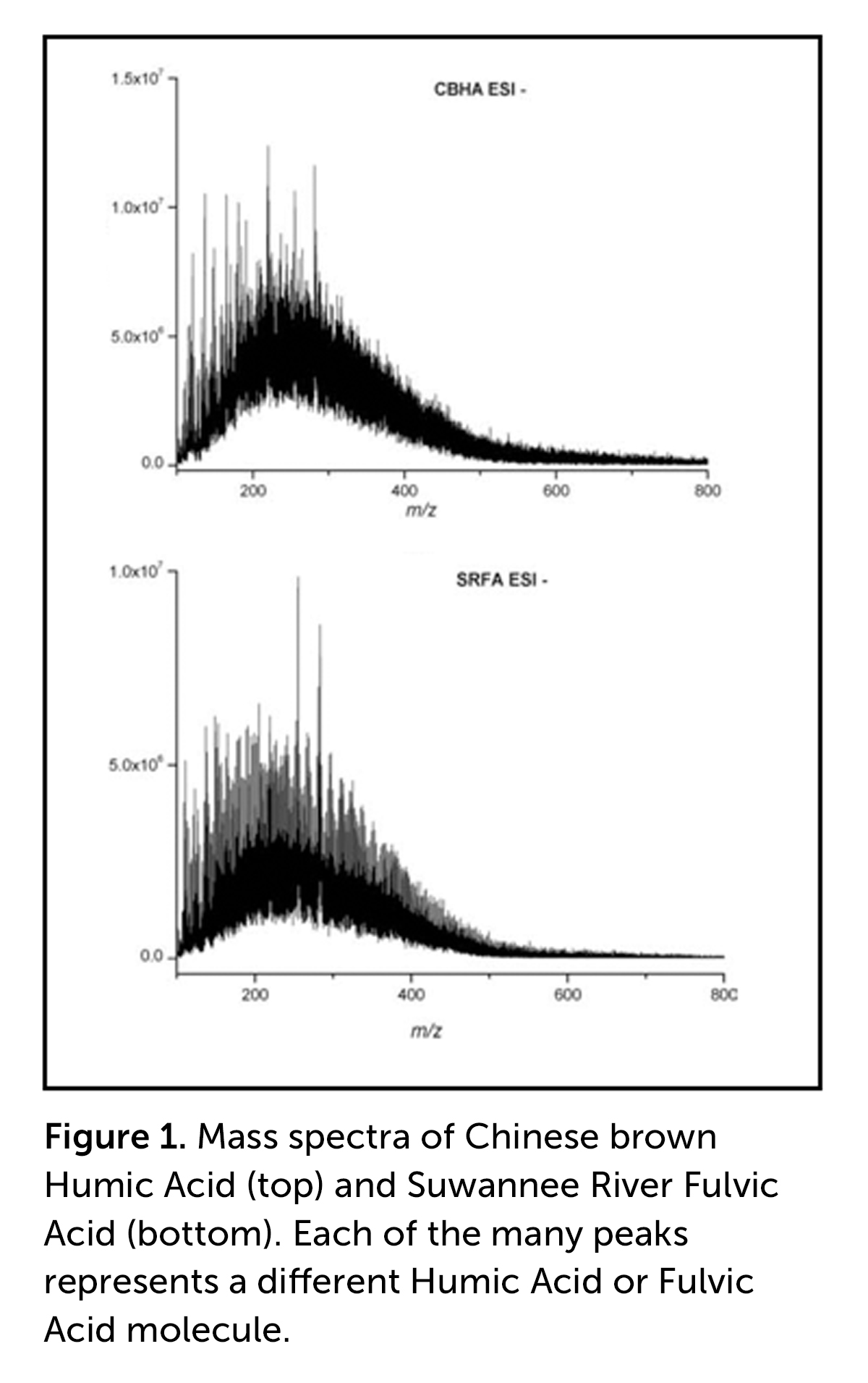
Para repasar, las definiciones operativas de AH y AF son que los AF son solubles en agua en todas las condiciones de pH, mientras que los AH son solubles en agua sólo en condiciones alcalinas. Así, en un extracto fuertemente alcalino, como Huma Pro® 16 (con un pH de 11,0-12,0), tanto el AH como el AF son solubles, principalmente porque se convierten en sales (por ejemplo, sales de potasio), están totalmente cargados negativamente y las moléculas cargadas negativamente se separan y se repelen entre sí. Si se disminuye el pH a pH 1, por ejemplo con ácido clorhídrico concentrado (HCl), todos los grupos COOH y Ar-OH se vuelven a protonar (es decir, se añade un átomo de H al COO cargado negativamente– y Ar-O– grupos) y el AH precipita porque ya no hay cargas negativas que repelan a las moléculas de AH, y ya no es soluble en agua.
Las moléculas de AF, que poseen abundantes COOH y Ar-OH, así como otros grupos funcionales que contienen oxígeno, permanecen en solución porque la presencia de todos estos grupos hace posible el enlace H con el H2O. Por el contrario, las moléculas de AH, que poseen un número limitado de grupos funcionales que contienen oxígeno y que no poseen suficiente fuerza mediante enlaces H en comparación con el tamaño de las moléculas para mantenerlas solubles, se vuelven más hidrófobas (es decir, repelen el H2O). Como resultado, las moléculas de AH empiezan a formar agregados hidrófobos, lo que finalmente provoca su precipitación. Así, cuando se añade Huma Pro® 16 a un fertilizante muy ácido (por ejemplo, Super Phos®), el AH precipita y es probable que obstruya las boquillas de pulverización. [Consulta nuestro vídeo sobre la Mezcla de Ácidos Húmicos Líquidos con Agroquímicos].
La conclusión es que los AH se diferencian de los AF, pero no por su tamaño molecular relativo. Se diferencian principalmente porque las moléculas de AF contienen un mayor número de grupos funcionales que contienen oxígeno, lo que les permite, mediante enlaces de hidrógeno, seguir siendo solubles en agua incluso en valores de pH muy ácidos.
Entradas relacionadas

¡Me encantan las lagunas!
Por Heather Jennings, PE De todos los sistemas de lagunas de aguas residuales en los que he estado, ¡nunca me he encontrado dos veces con la misma laguna! Muchos consideran que las lagunas son tecnología antigua, pero pueden ser sistemas de tratamiento muy fiables y más estables que muchos de los sistemas más sofisticados que

Esta semana en Ag #91
Hay un nuevo sheriff en la ciudad. O al menos vuelve uno viejo. Y hay un nuevo liderazgo en el Congreso. ¿Cómo afectarán los resultados de las elecciones a la agricultura?

Esta semana en Ag #102
Las cuatro caras del Monte Rushmore son agricultores. Además de ser el padre de nuestro país, George Washington fue el padre de la agricultura regenerativa, aplicando una intensa rotación de cultivos (cultivaba 60 cultivos diferentes), prácticas de cultivos de cobertura, gestión del estiércol y pastoreo de múltiples especies de ganado en su granja de Mt.

