Por Richard Lamar, PhD
Diretor de Pesquisas Húmicas
Bio Huma Netics, Inc.

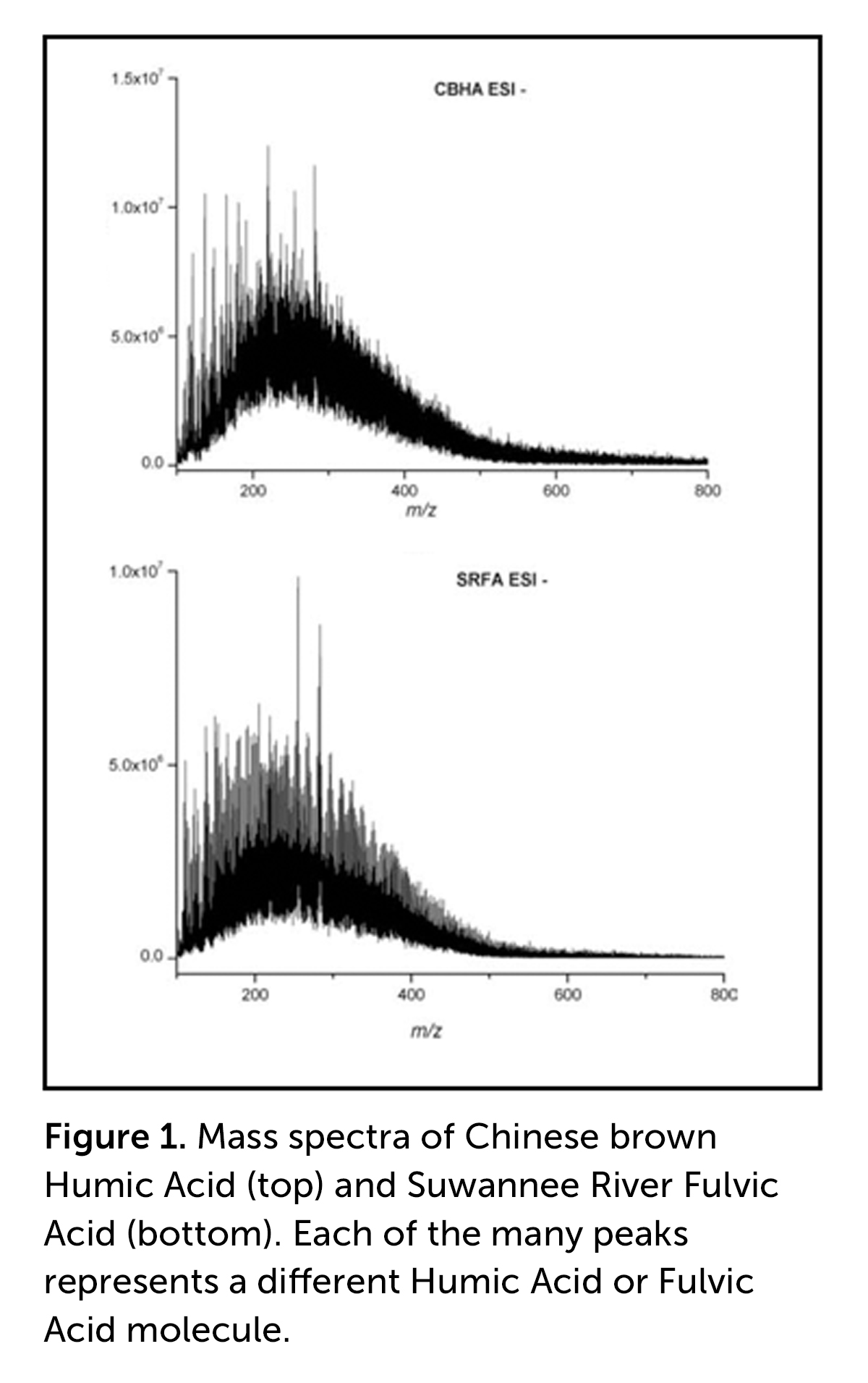
No entanto, a aplicação da espectrometria de massa de ressonância cíclotrônica de íons por transformada de Fourier (FT-ICR MS), que separa as moléculas com base no peso molecular, demonstra que os pesos moleculares das duas frações estão na faixa de 200 a 800 Daltons (Da), sendo que a maioria das moléculas tem pesos moleculares na faixa de 200 a 400 Da (Figura 1).
Para contextualizar, o carbono (C) pesa 12 Da, o oxigênio (O) pesa 16 Da e o hidrogênio (H) pesa 1 Da.
Assim, as moléculas de fenol (um composto orgânico aromático, também chamado de ácido carbólico), que têm 6 átomos de C, 1 de O e 11 de H, pesam 99 Da.
Nas substâncias húmicas, o oxigênio está presente principalmente na forma de ácidos carboxílicos (ou seja, COOH), fenóis (ou seja, Ar-OH; “Ar” significa aromático), álcoois e grupos carbonílicos (ou seja, C=O).
Esses grupos funcionais que contêm oxigênio possuem duas funções importantes que afetam muito o comportamento químico do HS.
São elas: (1) a capacidade de formar ligações de hidrogênio (por exemplo, com H2O), o que aumenta sua solubilidade, e (2) para COOH e Ar-OH, a posse de cargas negativas quando o H+ é perdido dos grupos OH de COOH e Ar-OH.
Essa segunda função é o que torna os HS ácidos.
Dependendo de sua localização em uma molécula, os grupos COOH podem perder um H+ e o O do OH se torna carregado negativamente à medida que o pH aumenta de 1 a 4.
Os grupos OH fenólicos podem perder um H+ e o O se torna negativamente carregado à medida que o pH aumenta de 7 a 9.
Para revisar, as definições operacionais de HA e FA são que os FA são solúveis em água em todas as condições de pH, enquanto os HA são solúveis em água somente em condições alcalinas.
Assim, em um extrato fortemente alcalino, como o Huma Pro® 16 (com pH de 11,0 a 12,0), tanto o HA quanto o FA são solúveis, principalmente porque se tornam sais (por exemplo, sais de potássio), são totalmente carregados negativamente, e as moléculas carregadas negativamente se separam e se repelem.
Se o pH for reduzido para pH 1, por exemplo, com ácido clorídrico (HCl) concentrado, todos os grupos COOH e Ar-OH se tornam protonados novamente (ou seja, um átomo de H é adicionado aos grupos COO- e Ar-O- carregados negativamente) e o HA precipita porque não há mais cargas negativas para repelir as moléculas de HA, e ele não é mais solúvel em água.
As moléculas de FA, que possuem COOH e Ar-OH em abundância, bem como outros grupos funcionais contendo oxigênio, permanecem em solução porque a presença de todos esses grupos possibilita a ligação H com H2O.
Por outro lado, as moléculas de HA, que possuem um número limitado de grupos funcionais contendo oxigênio que não possuem força suficiente por meio de ligação H em comparação com o tamanho das moléculas para mantê-las solúveis, tornam-se mais hidrofóbicas (ou seja, repelem H2O).
Como resultado, as moléculas de HA começam a formar agregados hidrofóbicos, o que acaba resultando em sua precipitação.
Portanto, quando o Huma Pro® 16 é adicionado a um fertilizante altamente ácido (por exemplo, Super Phos®), o HA precipita e pode entupir os bicos de pulverização.[Veja nosso vídeo sobre a mistura de ácidos húmicos líquidos com agroquímicos].
A mensagem a ser levada para casa é que o AH é diferente do AF, mas não por causa do tamanho molecular relativo.
Eles diferem principalmente porque as moléculas de FA contêm um número maior de grupos funcionais contendo oxigênio, o que permite que, por meio da ligação de hidrogênio, permaneçam solúveis em água, mesmo em valores de pH fortemente ácidos.
Publicações relacionadas

Esta semana em Ag #51
Em meados da década de 1980, esse estudante do ensino médio foi a uma reunião de fazendeiros com o pai. Um dos palestrantes era um consultor de commodities. Ele perguntou aos participantes, em tom de brincadeira, qual era o preço-alvo de suas colheitas. Ele ainda perguntou: “Quantos de vocês ainda estão esperando pelo retorno da

Esta semana em Ag #86
Ontem foi o #WorldCottonDay (Dia Mundial do Algodão). Esse é um título apropriado, considerando que a criação do tecido mais popular do mundo é realmente um esforço mundial. O algodão é uma cultura cultivada principalmente na Ásia e nas Américas, cujos produtos finais são projetados principalmente na Europa e fabricados principalmente na Ásia, e consumidos

O impacto das drogas ilícitas e de abuso comum no tratamento de águas residuais
Por Heather Jennings, PE, engenheira de projetos sênior da Probiotic Solutions® Eu estava participando de uma conferência sobre águas residuais e ouvi um operador falar sobre como uma apreensão de drogas fez com que sua lagoa ficasse laranja e quase o deixou fora de conformidade com sua licença. Em outro local, fui informado de que

